6月17日,生物治疗全国重点实验室钮大文教授团队联合北京大学深圳研究生院吴云东教授在Nature发表题为“Catalytic Glycosylation for Minimally Protected Donors and Acceptors”的研究文章。研究开发了一个通用平台,用于未受保护或受保护程度极低的供体和受体之间进行位点、立体和化学选择性O-糖基化反应。这项研究代表了糖化学领域的重大进展,为设计不依赖保护基团、由催化剂控制的糖基化反应提供了一种直接的方法,促进了对碳水化合物功能的探索。

我院生物治疗全国重点实验室博士生党湫菂、北京大学深圳研究生院博士生邓逸辉为共同第一作者,钮大文教授和吴云东教授为共同通讯作者。
低聚糖在生物学中具有多种功能,在重大疾病诊断、小分子药物研发、大分子靶向药物递送、免疫治疗等领域发挥着不可或缺的作用。要研究低聚糖的功能,亟需高效、简洁的方法对这些结构复杂的分子进行化学合成。然而,由于糖类分子结构复杂,具有多个手性中心和羟基,其合成过程面临挑战。化学家们历来需要通过保护基操作来控制O-糖苷化合成中的位点选择性、立体选择性和化学选择性,这极大地增加了合成工作的复杂性和成本。因此,未受保护或受保护程度极低的供体糖和受体糖之间如何实现高效、可控的O-糖苷化过程来合成糖类化合物是糖化学研究中亟待解决的科学问题。
研究团队设想通过催化剂控制策略来实现未保护糖之间高效、可控的O-糖苷化。团队前期构建了通过自由基策略将稳定易得的烯丙基糖基砜转化为活性糖基亲电试剂的方法(图中7、8)。这个糖供体活化策略已被证明能够兼容包括游离羟基在内的大多数极性官能团,为开发不依赖于导向基策略的催化体系提供了可能。如果能够设计催化剂(图中9)将亲核糖受体2与原位产生的亲电糖供体8通过合适的相互作用(如多个非共价和可逆共价作用)组装在一起,未受保护或受保护程度极低的的糖受体和供体间选择性O-糖苷化就有可能实现。
基于这一设想,研究团队精心设计了一类氨基硼酸催化剂,通过与糖的非共价氢键和可逆共价B-O键的相互作用,结合自由基活化烯丙基糖基砜形成糖基溴化物的策略,实现了未受保护或受保护程度极低的的糖受体和供体间选择性O-糖苷化。此外,通过调控氨基硼酸催化剂的结构,能够精准调控O-糖苷化的位置选择性。
该研究项目实验部分由钮大文教授团队完成,计算部分由吴云东教授团队完成;并得到了国家自然基金委优青项目和创新群体项目、四川大学科研院创新领军人才项目、四川大学华西医院1•3•5计划项目的支持。部分实验分析测试在四川大学分析测试中心帮助下完成。
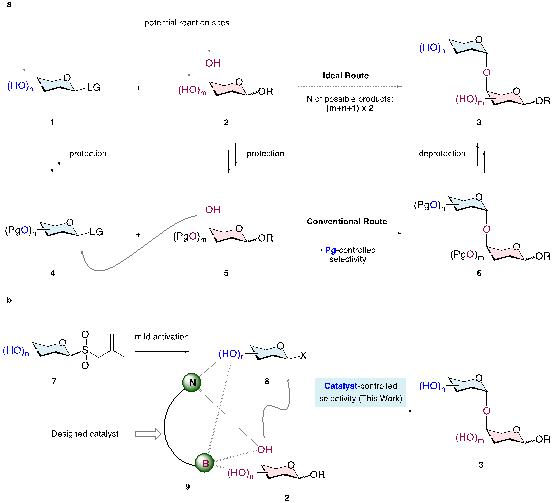
图. a) 低聚糖合成背景。b) 反应设计。