2026年1月,我院胸部肿瘤病房卢铀教授、薛建新教授团队在基因与细胞治疗领域的国际顶级期刊 Molecular Therapy在线发表题为“ Dual-targeting CD133/PD-L1 CAR-T plus αPD-1 overcomes immunosuppressive microenvironment and enhanced by radiation pre-conditioning”的研究论文。该研究构建了一种新型CD133/PD-L1双靶向CAR-T治疗策略,并提出通过桥接放疗联合PD-1抑制剂协同增强双靶向CAR-T,克服实体瘤免疫抑制微环境并增强CAR-T的抗肿瘤疗效。

我院胸部肿瘤病房姚卓然助理研究员、康凯助理研究员,甲状腺外科李沛衡助理研究员为共同第一作者;胸部肿瘤病房卢铀教授和薛建新教授为通讯作者;我院为第一作者单位。该研究得到了卓越发展“1·3·5”工程项目和国家自然科学基金-原创探索计划项目的支持。
CAR-T 细胞治疗在血液肿瘤中已取得突破性进展,但在实体瘤中的疗效长期受限,主要瓶颈包括靶抗原异质性、免疫抑制性肿瘤微环境以及 CAR-T 细胞浸润和持久性不足。尤其是PD-1/PD-L1免疫抑制轴的激活,被认为是限制CAR-T在实体瘤中发挥效应的关键机制之一。
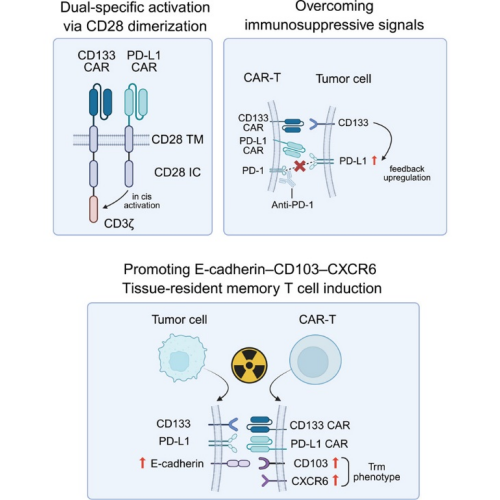
为应对上述挑战,研究团队设计了一种新型双靶CD133/PD-L1 CAR-T细胞产品。研究发现双靶向CD133/PD-L1 CAR-T细胞在多种CD133⁺实体瘤模型中表现出更强的激活表型、细胞因子分泌能力及体内外杀伤效应。然而,在PD-L1高表达肿瘤中,单纯双靶向CAR-T仍受到残余PD-1/PD-L1抑制信号限制。为此,研究团队构建了 “放疗+双靶CAR-T + PD-1抑制剂”的“三明治”新型组合模式。动物实验发现放疗可诱导一类 CXCR6⁺ CD103⁺ 组织驻留记忆样(Trm)CAR-T 细胞显著扩增。且上调肿瘤细胞中E-cadherin 的表达,从而增强其与CD103的相互作用,为CAR-T在肿瘤局部的滞留和长期效应提供了关键分子基础,构建了“放疗–E-cadherin–CD103–CAR-Trm” 的功能轴。
综上,本研究首创“放疗+双靶CAR-T + PD-1抑制剂”的“三明治”新型治疗实体瘤策略,并揭示放疗重塑CAR-T细胞命运的新机制,为临床转化治疗实体瘤提供了重要理论依据。
原文链接:https://pubmed.ncbi.nlm.nih.gov/41521560/