伦理审查委员会分为临床试验伦理审查委员会和生物医学伦理审查委员会,独立审查在我院开展的临床试验/研究,人员组成和功能符合临床试验/研究管理规范的相关要求。伦理审查委员会下设办公室,挂靠院办科教科。
临床试验伦理审查委员会审查范围:以申请药品/医疗器械注册为目的而开展的临床试验项目。包括II、III、IV期药物临床试验、器械临床试验和扩展临床试验(EAP临床试验)以及附条件批准的药品/医疗器械,药品/医疗器械上市许可持有人在规定期限内按照国家要求完成的相关临床试验项目。
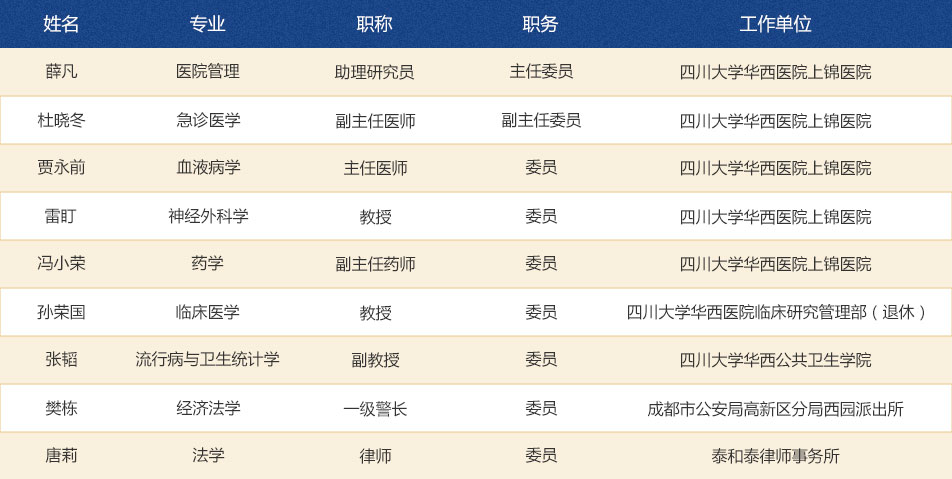
临床试验伦理审查委员会委员9人,主任委员和副主任委员各1名;医药相关专业人员7名(含伦理学专家、方法学专家各1名),非医药相关专业人员2名(含社区代表、律师各1名);院内人员5名,院外人员4名;男性8人,女性1人。名单如下:
生物医学伦理审查委员会审查范围:纵/横向课题与自拟课题、新技术研究等临床研究项目。
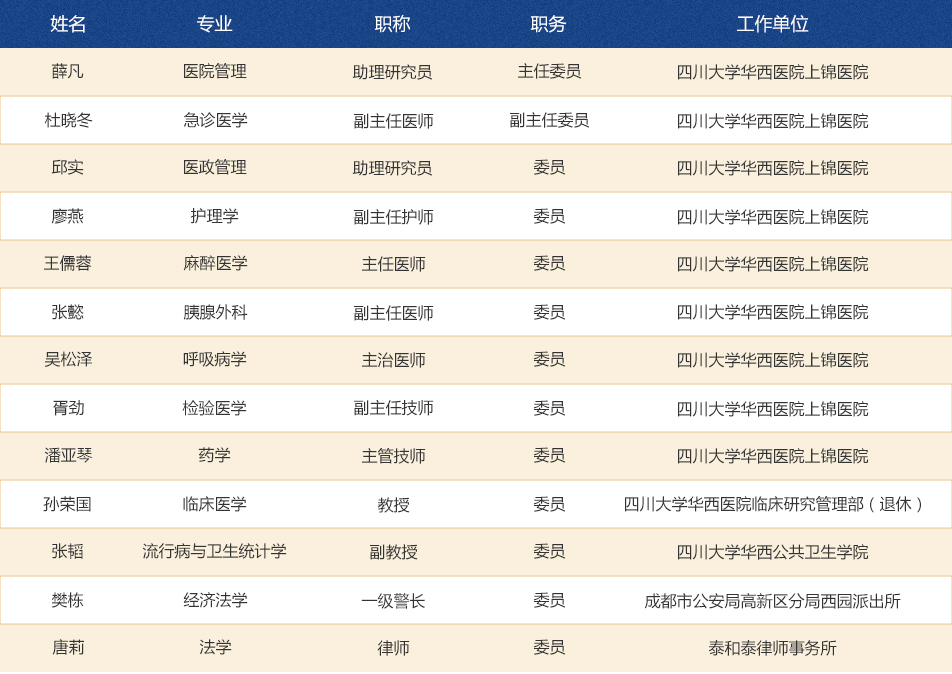
生物医学伦理审查委员会委员13人,主任委员和副主任委员各1名;医药相关专业人员11名(含伦理学专家、方法学专家各1名),非医药相关专业人员2名(含社区代表、律师各1名);院内人员9名,院外人员4名;男性8人,女性5人。名单如下:
伦理审查委员会任务:为保证临床试验和生物医学研究过程的规范,根据《中华人民共和国药品管理法》、《医疗机构管理条例》、《药物临床试验质量管理规范》、《药品生产质量管理规范》、《药物临床试验伦理审查工作指导原则》、《医疗器械质量管理规范》、《涉及人的生物医学研究伦理审查办法》、《中华人民共和国人类遗传资源管理条例》、《世界医学大会赫尔辛基宣言》等伦理准则,以及世界卫生组织有关伦理审查等管理指南,从保障受试者权益与安全的角度,严格审查临床试验和生物医学研究方案及其知情同意书等项目文件,检查并审议临床试验和生物医学研究有关的文件和/或事项等,并接受各级卫健委和药监局等上级单位检查督导。
伦理审查工作具有独立性,任何单位和个人不得干预伦理审查委员会的伦理审查过程及审查决定。
伦理办公室负责接收伦理申请,进行形式审查和伦理评审辅助性事务,协助主任委员准备并召开伦理评审会议,征求并汇总相关专家委员评审意见和建议,负责签收涉及试验(研究)的文件,签发伦理函件(如回复),进行有关日常伦理管理与咨询,负责伦理审查委员会管理文件和项目审查文件的整理、立卷、保存和使用等。
联系地址
Contact address
办公地点: 成都市高新西区尚锦路253号行政楼236办公室
行走路线:行政楼入口前30米,见山茶楼旁梯道口进入
办公时间:法定工作日(08:00- 12:00 , 13:00- 17:00)
联系人及电话:游进, 028- 62539215 ;微信,Y786714151
传真:028 - 62539009
邮箱:shangjinlunli@163.com












