2024年6月19日,我院重症医学研究所宋相容研究员团队联合哈佛大学医学院陶伟教授团队在Nature Nanotechnology(IF:38.1)发表最新研究论文:Resolvin D1 delivery to lesional macrophages using antioxidative black phosphorus nanosheets for atherosclerosis treatment的论文。研究开发了一种新型药物递送系统,为治疗动脉粥样硬化提供了一种新的方法,并展望了该系统用于治疗其他炎症性疾病的前景。

我院重症医学研究所、生物治疗全国重点实验室何中山博士,哈佛大学医学院陈纬博士和中国医学科学院药物研究所胡宽研究员为共同第一作者。宋相容研究员、陶伟教授为共同通讯作者。我院为第一完成单位。
动脉粥样硬化(Atherosclerosis,AS)是一种脂质驱动的动脉壁慢性炎症疾病,其持续炎症诱导的斑块聚集与破裂是引发心肌梗死或中风等心血管死亡事件的首要因素。尽管AS的发病原因复杂且难以捉摸,但新近研究表明巨噬细胞作为AS斑块微环境中含量最丰富的天然免疫细胞,其过度产生的活性氧(ROS)以及持续诱发的炎症免疫反应,是造成斑块聚集与破裂的主要原因。因此,靶向斑块巨噬细胞同时缓解炎症和抑制ROS生成对AS的精准治疗具有重要意义。
近年来,尽管载药纳米材料在心血管疾病治疗方面取得了快速发展,但其仍面临在斑块病变部位蓄积低、合成途径复杂和潜在毒性等诸多挑战,进而在临床转化应用方面遭遇阻碍。因此,迫切需要合成一种生物相容性良好的纳米材料,其不仅具有抗氧化和抗炎的功能,而且还能将药物精准递送至AS斑块疾病部位内巨噬细胞。
研究团队首次利用具有抗ROS功能的黑磷纳米片(BPNSs),与可以靶向斑块巨噬细胞的S2P多肽,开发了一种新型的纳米递送系统(BPNSs@PEG-S2P)。该系统不仅可以将促炎症消退药物RvD1特异且高效地递送至AS斑块巨噬细胞,而且本身可作为治疗药物,拥有优越的ROS清除能力和出色的抗炎功效。此外,该黑磷靶向纳米药物在多种AS动物模型中不仅能减少斑块面积,而且能显著提高斑块的稳定性,表现出良好的可重复性和非模型依赖性。重要的是,研究人员利用放射化学、流式细胞术、近红外成像和组织学等方法,系统地研究了BPNSs@PEG-S2P/R在AS模型小鼠体内的药代动力学、生物分布以及在AS斑块和血管细胞内的积累与相互生物作用等。最后,研究人员对斑块内巨噬细胞进行单细胞RNA测序分析,探究了该黑磷靶向纳米药物治疗动脉粥样的潜在机制。结果表明,该靶向药物可能主要通过调节相关基因或信号通路的表达,诱导巨噬细胞炎症和氧化应激消退,从而表现出优异的疗效。
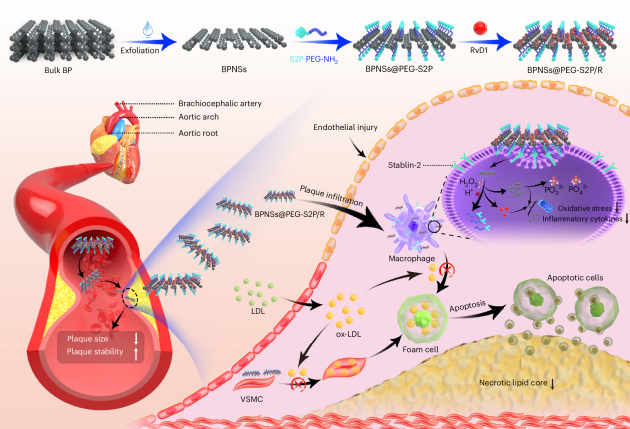
图1 | BPNSs@PEG-S2P/R的合成策略和抗动脉粥样硬化机制示意图