
2024年7月,我院临床药学研究所何金汗教授、李艳萍研究员团队在国际期刊Advanced Functional Materials (IF: 18.5)发表题为The Dual-Target Nanoparticles with ROS Sensitivity Inhibit the Hedgehog Signaling Pathway and Decrease Oxidative Stress in Activated Hepatic Stellate Cells to Alleviate Liver Fibrosis的研究论文。该研究构建了一种高活性氧响应性双靶向肝星状细胞的纳米递药系统,为肝纤维化治疗提供了新的策略。
肝纤维化是多数慢性肝脏疾病的共同病理过程,以肝脏内过量的活性氧累积、肝星状细胞(HSC)的活化、以及细胞外基质的过度沉积为主要特征。由于HSC的活化受多种因素调控且其在肝脏中数量较少,单一药物治疗的疗效非常有限。Hedgehog和Nrf2信号通路是调控HSC活化的重要信号通路。开发具有活性氧响应性释放同时靶向活化HSC的纳米递药系统,并同时作用于Hedgehog和Nrf2信号通路,将可能显著提升抗肝纤维化疗效。
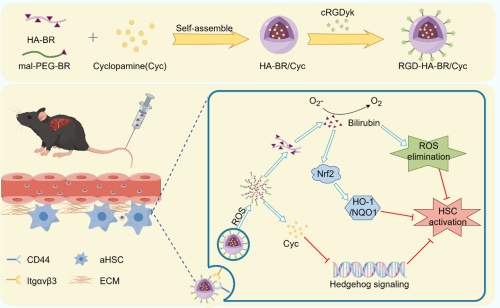
基于此,该研究利用活化的肝星状细胞高表达CD44受体与整合素受体αvβ3的特征,将CD44配体透明质酸(HA)与活性氧清除剂/响应剂胆红素共价连接,并将整合素受体αvβ3配体cRGDyk肽通过Mal-PEG修饰在透明质酸表面,同时包载Hedgehog信号通路抑制剂环巴胺(Cyclopamine, Cyc),构建多功能纳米递药系统RHB/Cyc。体外研究结果表明,RHB/Cyc纳米粒能够特异高效地靶向活化的肝星状细胞并响应高活性氧环境释药;全身给药后,RHB/Cyc纳米粒靶向分布于纤维化的肝脏组织,且主要蓄积于活化的肝星状细胞。进一步的机制研究发现,RHB/Cyc一方面通过清除活性氧激活Nrf2信号通路,另一方面通过靶向抑制Hedgehog通路,共同抑制肝星状细胞的活化。RHB/Cyc纳米粒有效缓解了四氯化碳(CCl4)及蛋氨酸胆碱缺乏饮食(MCD)诱导的小鼠肝纤维化,且无明显的全身毒副作用。这种精准靶向活化肝星状细胞并响应高活性氧微环境控释抗肝纤维化药物Cyc的递送系统,有望为肝纤维化的治疗提供新思路。
本文通讯作者为我院临床药学部主任、临床药学研究所所长何金汗教授,临床药学研究所副所长李艳萍研究员,第一作者为在职博士后张金行、张婷副主任药师。该研究工作得到了国家自然科学基金、四川省科技厅及我院1·3·5高端人才项目等资助。
原文链接:https://doi.org/10.1002/adfm.202404658