近日,我院腹部肿瘤病房曹丹教授联合生物治疗国家重点实验室赵成建教授、胰腺外科田伯乐教授团队在《Signal Transduction and targeted therapy》(IF: 40.8)上发表题为“Spatial interactions of immune cells as potential predictors to efficacy of toripalimab plus chemotherapy in locally advanced or metastatic pancreatic ductal adenocarcinoma: a phase Ib/II trial”原创性临床研究论文。该研究基于化疗联合免疫治疗用于进展期胰腺癌的临床研究,结合患者的生物样本,应用创新的肿瘤免疫微环境多色免疫荧光染色技术CmTSA (cyclic multiplex tissue staining assay)和人工智能空间分析,精准预测进展期胰腺癌接受免疫治疗的获益人群,为胰腺癌精准个体化免疫治疗提供重要的参考依据,文章作者均为我院胰腺癌MDT团队核心成员。
进展期胰腺癌预后极差,化疗是其主要的标准治疗手段,但疗效仍不理想。由于胰腺癌具有十分特殊的肿瘤微环境特征,其对传统免疫治疗疗效不佳,免疫治疗一直面临诸多挑战和局限性。目前针对进展期胰腺癌所开展的化疗联合免疫治疗的临床研究也均显示出十分有限的疗效,化疗联合免疫治疗的有效性和安全性值得进一步临床验证。因此,团队发起化疗联合PD-1单抗治疗晚期胰腺癌的IIT临床研究,来进一步探索其治疗价值。
近年来,PD-1单抗已经在多种晚期实体瘤中显示出了较好的疗效和价值,但单独靶向PD-1/PD-L1的免疫治疗在晚期胰腺癌的探索中均以失败告终,原因在于胰腺癌特殊的肿瘤免疫微环境特征,淋巴细胞难以浸润并呈现出免疫抑制性的特征。部分小样本研究虽然已经初步发现化疗联合免疫治疗能够在晚期胰腺癌中显示疗效,但大多数研究仍发现只有部分人群能从化疗联合免疫治疗中获益,故筛选出这部分获益人群的生物标志物特点具有十分重要的意义。团队也进一步基于这项IIT临床研究的疗效数据,利用基于CmTSA 技术分析患者肿瘤组织中的免疫微环境特点,来进一步筛选出能从化疗联合免疫治疗获益的胰腺癌人群,来实现胰腺癌精准化免疫治疗。
研究团队历经近4年时间,成功入组72例既往未经过系统治疗的晚期胰腺癌患者一线接受GnP方案化疗联合PD-1单抗免疫治疗,并对患者进行长期的安全性和生存随访,以及疗效评估。研究中,没有发现严重的治疗相关不良事件和4级免疫相关不良事件。72例患者中位总生存时间为8.9个月,客观有效率为33.3%,疾病控制率为90.3%。同时也分析了免疫相关的生物标志物,包括程序性死亡配体1 (PD-L1)表达、基因突变状态、外周血细胞因子水平和肿瘤组织的肿瘤免疫微环境的空间特征与疗效的相关性,并发现常规的生物标志物难以对体现疗效和未显示疗效者进行可靠地区分。因此,临床团队与生物治疗国家重点实验室赵成建教授团队结合临床数据对患者的组织样本进行了全面地检测和分析,基于CmTSA技术既分析了肿瘤免疫微环境中的细胞成分,也同时揭示了这些细胞间的空间结构对疗效的预测作用,发现富集了树突状细胞-T辅助细胞-细胞毒性T淋巴细胞(DC-Th-CTL)免疫功能域及其空间相互作用可作为化疗联合免疫治疗的主要疗效预测因子。并提出GnP方案化疗联合PD-1单抗免疫治疗在晚期胰腺癌的一线治疗中具有良好的安全性,并且在特定的人群中表现出疗效,DC-Th-CTL的免疫功能域及其空间相互作用有望作为晚期胰腺癌患者接受化疗联合免疫治疗的预测指标。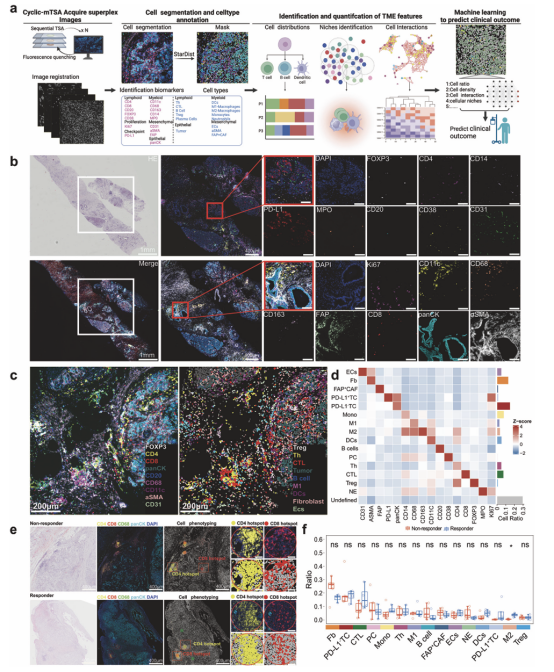
CmTSA技术的染色流程及检测结果显示的肿瘤免疫微环境中的细胞成分在治疗疗效存在差异的患者中的比较
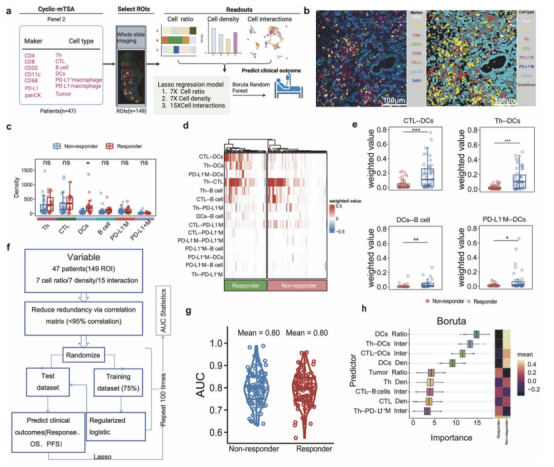
DCs及其与CTL和Th的相互作用是治疗反应的主要预测因子
该研究显示了免疫治疗联合化疗在进展期胰腺癌患者一线治疗中的安全性和有效性,并结合患者生物样本进行了以肿瘤免疫微环境为主的疗效预测标志物的探索。研究发现了能够有效筛选胰腺癌免疫治疗精准化获益人群的新方法及新的检测技术,也为突破免疫治疗在进展期胰腺癌中的应用打开了新思路。
我院腹部肿瘤病房曹丹教授、生物治疗国家重点实验室赵成建教授、胰腺外科田伯乐教授为本文共同通讯作者,我院腹部肿瘤病房成科副教授、李小英博士为本文共同第一作者。该研究体现出腹部肿瘤病房胰腺癌亚专业组内科团队、胰腺外科团队、生物治疗国家重点实验室基础研究团队三方跨学科紧密协作,凝聚胰腺癌MDT团队力量,破解临床复杂难题,为患者提供精准、创新的个性化诊疗方案。
原文链接:https://www.nature.com/articles/s41392-024-02031-8?sid_for_share=99125_3