2022年3月10日-11日,第19届欧洲神经内分泌肿瘤学会年会(ENETS)以线上线下结合的方式在巴塞罗那顺利召开。大会内容精彩纷呈,在药物治疗方面遍地开花,在靶向治疗、化疗、免疫治疗、PRRT等领域均有新的研究成果公布,因此我们精选了其中三项研究以飨读者。
1.高级别神经内分泌肿瘤的治疗——未来可期
G3神经内分泌瘤和神经内分泌癌进展迅速,预后差,药物疗效差,一直以来是治疗的难题。本次大会对于高级别神经内分泌肿瘤(NEN)的讨论非常热烈,从基因图谱到新的化疗方案、化疗联合靶向治疗、免疫治疗等方面均有可喜的成果公布。
1.1老药新用——依维莫司联合替莫唑胺用于高级别NEN
Siren Morken教授团队的ET-NEC研究(Poster I19)将神经内分泌肿瘤的经典药物依维莫司和替莫唑胺联合用于高级别神经内分泌肿瘤的一线治疗,主要研究终点为6个月疾病控制率(DCR),次要研究终点包括客观缓解率(ORR)、生存期、安全性和生活质量(QoL)。该项前瞻性、多中心、单臂II期研究共纳入37例转移性高级别神经内分泌肿瘤患者,既往未接受过系统治疗,其中26例患者为NET G3,9例为NEC;8例患者原发灶不明,29例患者的原发灶为消化道(包括胃、肠、胰腺、食管、胆囊);中位Ki67指数为37%,30例患者Ki67≤55%,7例患者Ki67>55%。结果表明,所有患者的6个月DCR为64.9%,ORR为30%,NEC患者的ORR略高于NET G3(33.3% vs 27%),Ki67≤55%患者的有效率高于Ki67>55%的患者(33% vs 14%);所有患者的中位PFS为10.2个月,中位OS为26.4个月,NET G3比NEC患者的PFS和OS均明显延长(PFS:12.6个月 vs 3.4个月,p=0.133;OS:31.4个月 vs 7.8个月,p=0.003),Ki-67≤55% 的患者比> 55%的患者预后好(PFS:12.2个月 vs 3.9个月,p < 0.001;OS:30.1个月 vs 8个月,p < 0.001)。在安全性方面,43%的患者报告了3级毒性,38%的患者报告了4级毒性,70%出现剂量限制性毒性,主要表现为中性粒细胞减少、血小板减少、肺炎、疲乏和口腔炎,但在前4个月治疗期间,患者的生活质量评分没有显著改变。
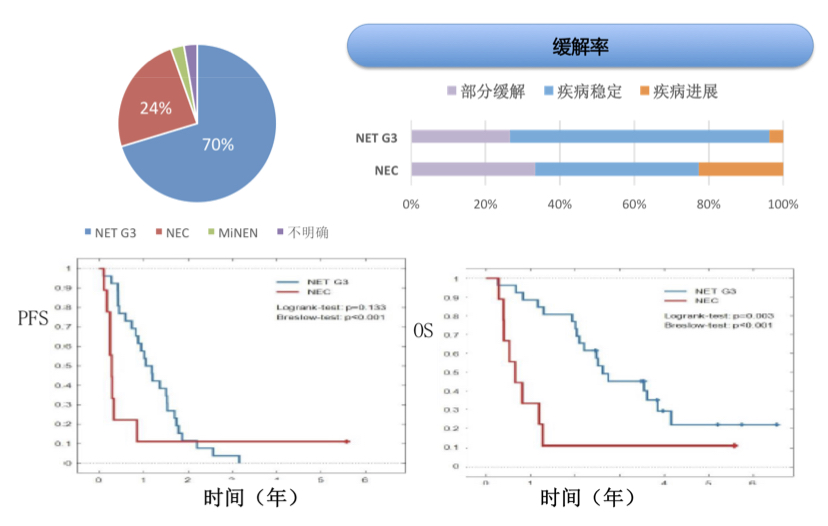
图1. ET-NEC研究主要结果
1.2曙光初现——免疫治疗用于高级别NEN
来自西班牙NET工作组团队报告了NICE-NEC研究初步结果。该项多中心、单臂2期研究的主要目的为在晚期肺外高级别NEN(NET G3及NEC)患者中探索一线PD-1单抗(纳武单抗)联合标准化疗(依托泊苷+卡铂方案)的有效性和安全性,主要研究终点为12个月OS率,次要研究终点为ORR、DCR、PFS、OS及安全性。截止大会报道,共纳入38例患者,其中26例(68.4%)为NEC,12例(31.6%)为NET G3,大部分患者(65.8%)Ki67指数>55%,除8例患者为原发灶不明外,其余患者均为胃肠胰来源的NEN。目前OS数据尚未成熟,大会报道了分层分析的ORR和PFS,结直肠来源的患者ORR(16.7%)及PFS(3.3个月)均明显差于非结直肠来源的患者,其中十二指肠/回肠来源的患者疗效最优(n=2, ORR: 100%, mPFS: 12.7个月),而按Ki67指数及组织学分级的分层分析没有统计学差异。
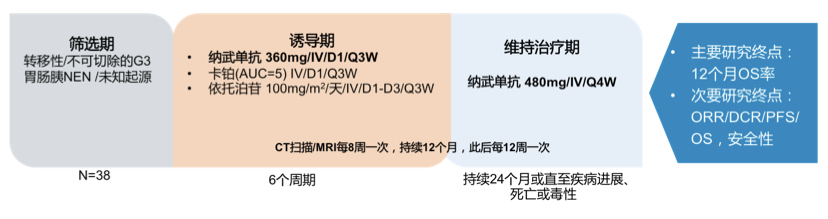
图2. NICE-NEC研究设计
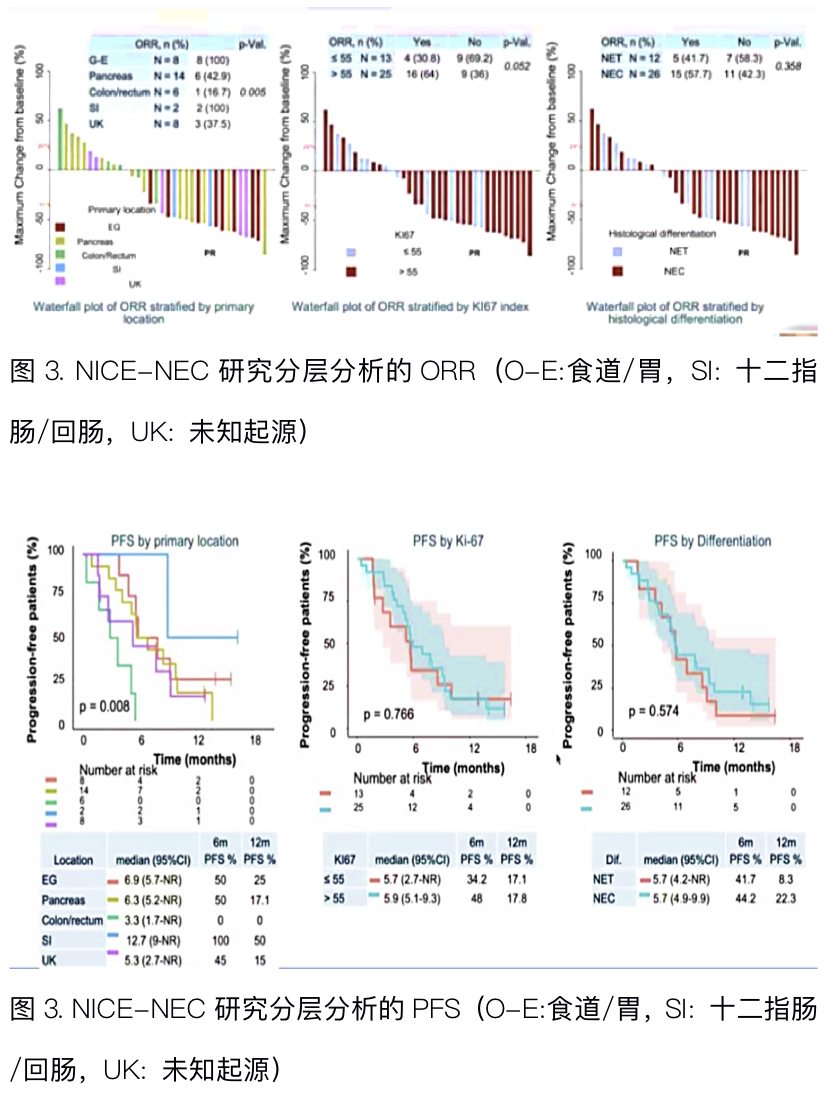
点评:胃肠胰NET G3及NEC的治疗一直是临床实践的热点和难点,其最佳治疗方案仍有待确定,既往我们很少联用小分子靶向药物和化疗药物。ET-NEC研究(Poster I19)将靶向药物和化疗结合,也是一种新的探索,研究一线依维莫司和替莫唑胺用于高级别神经内分泌肿瘤的疗效和安全性,虽然病例数有限,但仍取得了不错的PFS和OS,低Ki67指数和分化好的患者预后较好。提示对于体力状况良好的高级别NEN患者,靶向药物依维莫司联合替莫唑胺化疗可作为NET G3一种选择,期待大样本随机对照试验的结果。
近年来,以PD-1/PD-L1单抗为代表的免疫检查点抑制剂在各种恶性肿瘤中取得了惊人的疗效,然而在神经内分泌肿瘤中,免疫治疗出师不利,可能与肿瘤突变负荷低、PD-L1阳性率低等有关。迄今为止,只有阿替利珠单抗及德瓦鲁单抗联合化疗的III期临床试验在肺小细胞神经内分泌癌中取得了阳性结果(IMpower133,CASPIAN研究),而NET G1-G3及肺外NEC目前尚无关于一线免疫治疗的III期临床研究结果。NICE-NEC研究将PD-1单抗联合EC方案化疗用于高级别胃肠胰NEN的一线治疗,大部分患者为NEC,该研究的初步结果发现非结直肠来源和Ki-67>55%患者的ORR更高,非结直肠来源的患者PFS更长,尤其是十二指肠/回肠来源的患者,中位PFS可达12.7个月,虽然目前生存数据尚不成熟,基因检测及肿瘤微环境情况也未公布,但仍然让我们看到了高级别NEN治疗的曙光,免疫治疗联合化疗未来可能成为主流治疗方案。
2.Belzutifan治疗VHL综合征相关pNET——实至名归
von Hippel-Lindau (VHL)综合征为常染色体显性遗传病,是抑癌基因VHL胚系突变引起VHL蛋白表达下降或失活所致,VHL蛋白参与缺氧诱导因子(HIF)的降解,当VHL蛋白表达下降或失活时,HIF降解减少,作为重要的转录因子, HIF过表达将激活下游与血管生成、细胞增殖和肿瘤发生相关的一系列基因(如VEGF、Cyclin D1、PDGF、TGFα等),从而引导致多种肿瘤的发生,包括肾透明细胞癌、中枢神经系统血管母细胞瘤、胰腺神经内分泌肿瘤、嗜铬细胞瘤、副神经节瘤等。Belzutifan是口服小分子HIF-2α抑制剂,在VHL综合征相关肾细胞癌的II期临床试验(NCT03401788)中表现优异,ORR达到49%(n=61),在该项研究中,所有患者均有胰腺病变(包括pNET和囊腺瘤),其中pNET有22例,pNET的ORR高达91%。2021年8月,Belzutifan被美国FDA批准用于VHL综合征相关的肿瘤。在本次ENETS大会上,研究者公布了22例pNET的详细缓解情况。经独立中心审查评估,所有22例pNET的靶病灶均缩小,3例患者达到CR,17例患者达到PR,2例SD,中位随访21.8个月后,Belzutifan表现出持久的抗肿瘤活性和良好的耐受性,目前中位缓解持续时间尚未达到。
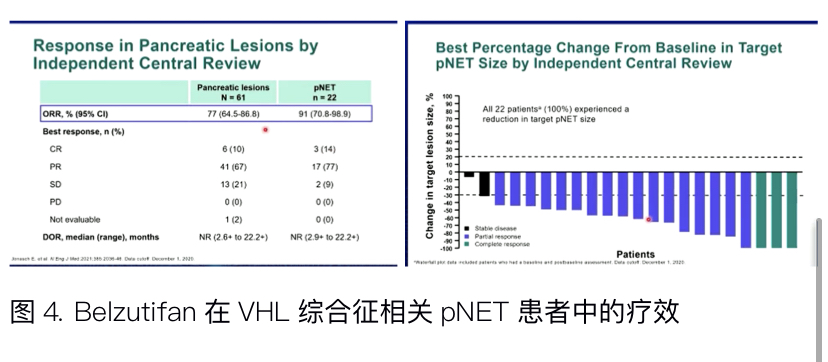
点评:VHL综合征患者因携带VHL基因胚系突变,常常会发生多种肿瘤,既往治疗以手术切除为主,病人一生中往往要经历多次手术,不仅痛苦,且容易复发或转移。Belzutifan让我们看到了一种全新的无创伤疗法,且疗效惊人。目前该药已经被美国FDA批准用于VHL综合征相关的肿瘤,且关于嗜铬细胞瘤/副神经节瘤或pNET的全球多中心临床研究正在进行,希望也能早日完成临床研究,为患者带来福音。