2023年11月15日,生物治疗全国重点实验室干细胞与组织工程研究室解慧琪研究员团队在Science Advances(IF:13.6)在线发表了题为Promotion of uterine reconstruction by a tissue engineered uterus with biomimetic structure and extracellular matrix microenvironment的研究论文。该研究构建了一种“结构+ECM微环境”仿生的组织工程子宫修复支架,系统研究了组织特异性的细胞外基质(Extracellular matrix,ECM)在募集内源性干细胞,诱导干细胞定向分化中的作用,并展示了该仿生支架用于重度宫腔粘连(intrauterine adhesions,IUA)修复的可行性。

宫腔粘连(IUA)是女性继发性不孕的主要原因,但是传统治疗方法治疗效果不佳。重度IUA复发率高达60%,更有效的预防和治疗IUA的方法仍有待开发。重度IUA往往伴有子宫肌层的损伤,常导致子宫局部缺血和缺氧,严重影响子宫修复效果。因此,在重度IUA的治疗中,给予适当的机械支持、建立抗粘连屏障、实现子宫内膜和子宫肌层的同步再生至关重要。然而,单一支架很难满足重度子宫损伤修复的多重需求。受子宫结构的启发,该研究开发了一种具有仿生异质特性和细胞外基质微环境的双层支架(ECM-SPS),以满足子宫的多种修复需求。该仿生支架具有类似于子宫解剖结构的两个不同区域,仿生子宫内膜(SIS)表面致密光滑,可作为防止粘连的物理屏障。仿生肌层(PU/SIS)具有与子宫肌层相似的力学性能,可以提供合适的力学支撑(Fig. 1)。研究证明,该支架在子宫全层缺损修复中可维持正常子宫形态,预防狭窄或粘连的发生。

图1 仿生子宫结构的双层支架制备
子宫内膜干细胞的丢失和组织微环境的实质性改变被认为是子宫病理性再生的主要原因。子宫内膜干细胞的功能在很大程度上受到修复部位微环境的限制,募集内源性干细胞和构建良好的修复微环境有望实现子宫功能性再生。作为组织微环境的重要组成部分,ECM可以调节细胞表型和功能以响应各种生理和病理刺激,特别是诱导干细胞谱系分化。ECM通常来源于动物组织,然而其批次差异大,面临着更多的免疫排斥和生物安全风险。该研究巧妙地运用组织特异性来源的细胞生产ECM,以模拟天然组织ECM微环境,诱导组织功能性再生。研究发现,组织特异性细胞来源的ECM具有与天然组织相似的ECM特征,可模拟组织ECM微环境,诱导干细胞定向分化。此外,子宫上皮来源的ECM可以募集内源性干细胞参与子宫内膜修复(图2 B),平滑肌细胞来源的ECM更多表现出促进血管新生的作用(图2 C)。
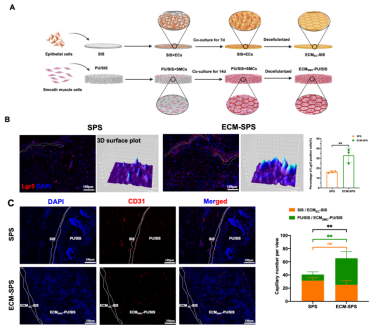
图2 ECM-SPS的制备及生物学功能评价
在子宫全层缺损重建中,该仿生支架展现出快速上皮化的能力,并且促进内膜腺体和肌层的再生(图3 A-B)。此外,该仿生支架对卵巢功能并无影响,动情周期及卵泡数目与正常大鼠相较均无差异。经该仿生支架重建后的子宫可以维持胚胎孕育、活产胎儿,具有更高的受孕率(图3 C)。
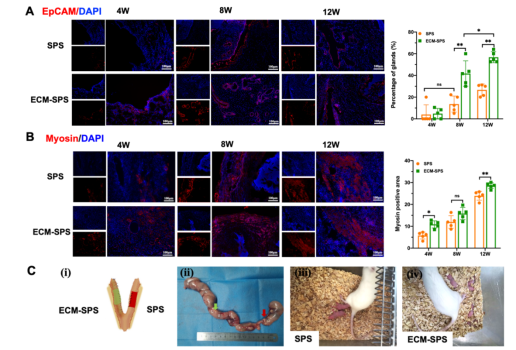
图3 子宫修复效果评价
该研究表明,ECM-SPS在治疗和预防重度IUA方面具有较大的潜力。该研究提出的“结构+微环境”仿生的ECM材料构建策略为复杂组织结构的器官再生提供更好的选择。
我院博士研究生赵龙梅、笪琳萃为第一作者,解慧琪研究员为通讯作者。该研究得到国家自然科学基金、四川大学医学+材料中心、我院1·3·5卓越学科建设项目、天府锦城实验室(前沿医学中心)的资助。