近日,我院泌尿外科曾浩教授团队联合病理科陈铌教授团队在Genome medicine(IF:15.266)在线发表题为Genomic and transcriptomic features between primary and paired metastatic fumarate hydratase–deficient renal cell carcinoma的研究论文。该研究首次揭示了延胡索酸水合酶缺陷性肾细胞癌(FH-RCC)转移病灶的基因组、表观基因组和转录组特征,描绘了FH-RCC的早期进化轨迹,为探索转移性FH-RCC的系统治疗方案提供了新证据。

泌尿外科曾浩教授、病理科陈铌教授、泌尿外科刘振华副教授和张兴明讲师为共同通讯作者。泌尿外科梁嘉宇副研究员、孙光曦副研究员、沈朋飞副教授、朱莎博士、病理科潘秀懿讲师和张孟尼主治医师为共同第一作者。我院泌尿肿瘤MDT团队及国内多家协作单位为该课题的研究提供了大力支持。
延胡索酸水合酶缺陷性肾细胞癌(FH-RCC)是由编码延胡索酸水合酶的FH基因发生功能缺失性突变所导致的罕见肾癌亚型,其发病率仅为1/10,0000。FH基因胚系或体系突变均可导致FH-RCC,胚系突变的FH-RCC又称遗传性平滑肌瘤病和肾细胞癌综合征(HLRCC)。该遗传性肾癌综合征为常染色体显性遗传,其发病具有家系遗传特征,患者除发生肾脏恶性肿瘤外,还可合并子宫、平滑肌瘤等良性病变。与透明细胞肾细胞癌(ccRCC)等常见肾癌类型相比,FH-RCC具有发病年龄早、诊断难度大、恶性程度高、极易发生早期转移等临床特点,转移性FH-RCC患者中位生存时间不足10个月(4.5-13个月)。然而,由于FH-RCC的发病率极低,人们对FH-RCC转移病灶基因组、表观基因组及免疫微环境等多组学特征的认识非常有限。若能获取FH-RCC肿瘤转移病灶的多组学信息,则更有希望阐明该类型肿瘤转移进化的特征,为转移性FH-RCC的治疗提供新的策略。
研究团队收集了来自国内19个省市的多中心FH-RCC队列共计90例FH-RCC病例,随后选取其中具有可获取石蜡包埋手术样本的19例原发灶-转移灶配对病例进行全外显子、甲基化、转录组测序。研究发现,FH-RCC转移病灶和其配对的原发病灶总体上表现出相似的基因组学特征,包括肿瘤突变负荷(TMB)、肿瘤新抗原负荷(TNB)、微卫星不稳定性评分(MSI)、拷贝数变异负荷(CNV burden)和基因组不稳定性指数(WGII)。这些特征与曾浩教授团队此前在Clinical Cancer Research期刊上发表的针对FH-RCC原发灶的研究结果一致。特别的是,在合并NF2基因突变的病例中,其转移灶相较原发灶具有更高的基因组不稳定性。转移灶中22号染色体长臂缺失(22q loss)事件则被发现与患者骨转移密切相关。
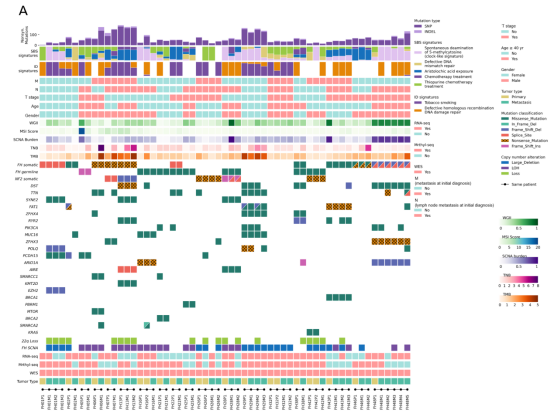
为了探究FH-RCC在疾病早期极容易发生转移这一恶性特征,团队进一步对多点取材的原发病灶、转移病灶进行了系统进化和克隆进化分析,并绘制了FH-RCC克隆进化轨迹。研究发现,无论是同时转移还是异时转移,转移病灶中肿瘤细胞的最近共同祖先(MRCA)克隆即为FH基因突变的原始克隆。这一结果显示,发生FH基因突变的原始克隆已经具备了转移能力,而不需要通过其他继发的驱动事件来获得转移能力。这一研究结论从肿瘤进化的角度揭示了FH-RCC早期转移的分子特征。
随后,团队采用RNA-seq、免疫组化及多重免疫荧光实验,对FH-RCC转移灶的转录组和免疫微环境特征进行了分析。研究发现FH-RCC转移灶与原发灶均具有较高的免疫原性,但转移灶表现出更高的效应T细胞富集信号以及趋化因子信号。与此同时,转移灶中免疫检查点TIGIT,BLTA和PD-L1表达显著上调。在合并NF2基因突变的转移灶中,细胞周期信号明显更加活跃。这些研究结果一方面为PD-1/PD-L1抑制剂治疗提供了依据,另一方面还为转移性FH-RCC系统治疗提供了更多的潜在靶点。基于前期一系列科研成果,曾浩教授团队在国际范围内率先开展了以免疫治疗为基础的FH-RCC国内多中心临床研究(NCT04387500)。
该研究受到国家自然科学基金、四川省自然科学基金、国家博士后基金、四川大学华西医院1.3.5交叉学科创新项目-重大项目的资助。
原文链接:
https://genomemedicine.biomedcentral.com/articles/10.1186/s13073-023-01182-7