6月12日,我院魏霞蔚团队联合华西口腔邵彬副研究员,在PNAS杂志(IF:11.1)发表了最新研究论文“Inhibition of NLRP3 Inflammasome Activation by A20 through Modulation of NEK7”,揭示了A20调控NLRP3炎症小体新机制。四川大学华西医院为本课题第一完成单位,四川大学华西医院副教授余佳耘及四川大学华西口腔医院博士生李函文、硕士生吴永杳为本文共同第一作者(共3人),魏霞蔚研究员、四川大学华西口腔医院邵彬副研究员为共同通讯作者。该研究得到国家自然科学基金委等经费支持。

NLRP3炎症小体是先天性免疫的重要组成部分,在宿主抵御感染和调控无菌性炎症等免疫反应中起重要作用。其过度活化与多种人类炎症性疾病密切相关,包括脓毒血症、炎症性肠炎、糖尿病和牙周炎等。因此,深入了解NLRP3炎症小体的调控机制对炎症性疾病预防、药物靶点发现具有重要指导意义。
既往研究显示,A20缺失的巨噬细胞中NLRP3炎症小体自发激活,而AIM2和NLRC4等炎症小体不受影响。其可能的机制是A20通过NF-κB负调控NLRP3和pro-IL-1β的转录,抑制NLRP3炎症小体的启动;通过阻断pro-IL-1β的K-63泛素化,抑制NLRP3炎症小体的自发激活。然而上述机制似乎不能合理解释A20抑制NLRP3炎症小体的特异性。A20可能通过其他未知机制特异性抑制NLRP3炎症小体活化。
NIMA相关蛋白激酶7(NEK7)是NLRP3炎症小体激活的关键分子,它与NLRP3直接结合,调控NLRP3的寡聚化及后续炎症小体组装。研究者发现A20缺失的原代巨噬细胞(A20myel-KO BMDM)和巨噬细胞系(A20KO iBMDM)中NEK7的转录水平和蛋白水平均增加,后续实验证明NEK7的转录增加与NF-κB信号通路激活有关。随后经一系列实验发现,A20能够直接与NEK7结合,并且通过泛素化作用,促进NEK7的降解。
研究者进一步发现,A20能够显著抑制NEK7与NLRP3的结合。在这个过程中,A20的OTU结构域以及ZnF4协同ZnF7结构域发挥关键作用。随后研究者根据A20的OTU结构域特点,设计出了靶向NEK7的多肽,经表面等离子体共振(SPR)检测发现,这些多肽与NEK7具有优良的结合能力,并能够显著抑制NLRP3炎症小体的活化。最后研究者通过单细胞数据分析发现NEK7的表达与脓毒血症的进展相关,并且巨噬细胞中缺失NEK7的条件敲除小鼠(NEK7myel-KO)或者经靶向NEK7多肽治疗的小鼠对LPS的冲击具有更好的耐受性,提示NEK7是脓毒血症潜在的治疗靶点。
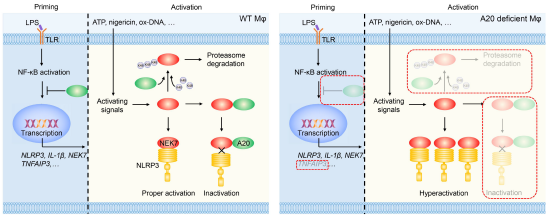
综上所述,该研究从A20抑制NEK7的基因转录、介导NEK7的K-48泛素化以及抑制NEK7与NLRP3结合三个层面综合阐述了A20调控NLRP3炎症小体活化的新机制,为开发脓毒血症等炎症性疾病的靶向治疗提供了思路。