近日,我院肿瘤动物模型创制及应用研究室赵旭东研究员团队成功研发并制备了NKG2D-BBz CAR-T细胞,证实该细胞在体内外均能显著抑制肝癌发生,相关成果发表于Cancer Immunology Research (IF=8.619)。论文第一作者为实验室孙彬博士、杨东博士,通讯作者为赵旭东研究员,论文第一单位为四川大学华西医院。
肝癌是第六大常见恶性肿瘤,死亡率排第四。目前常规治疗手段对晚期肝癌患者效果有限,亟需其它更有效治疗方式。嵌合抗原受体T细胞疗法(CAR-T)治疗是一种新兴的细胞免疫疗法,目前已在血液恶性肿瘤中取得了巨大成功,有望拓展至实体瘤治疗相关领域。但由于实体瘤存在高异质性、特异性抗原的缺失和强的免疫抑制微环境等问题,限制了CAR-T在治疗实体瘤中的应用。
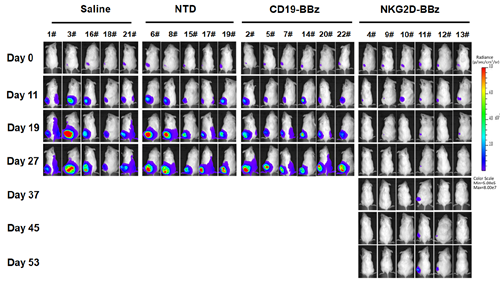
图1. NKG2D-BBz CAR-T 抑制肝癌的发生
NKG2D是一类表达于NK细胞、CD8+T细胞、部分CD4+T细胞、γδ T细胞等的一类分子,其配体(NKG2DLs)包括MICA、MICB、ULBP1-6等。赵旭东团队通过分析TCGA数据库样本、人常见肝癌细胞系、人肝癌组织和人正常组织芯片中NKG2DLs的表达,发现NKG2DLs一般在正常细胞不表达或低表达,而在肿瘤细胞中表达显著上调,预示该类蛋白是肿瘤免疫治疗的潜在靶点。因此赵旭东团队制备了可特异性识别NKG2DLs的NKG2D-BBz CAR T细胞。
研究表明该CAR-T细胞对NKG2DLs高表达的肝癌细胞系有显著杀伤作用,且细胞毒性与NKG2DLs的表达呈正相关。体内实验证实NKG2D-BBz CAR-T能显著抑制人肝癌细胞系SMMC-7721移植瘤的发生(图1)。与已有靶向实体瘤的CAR-T相比,NKG2D CAR-T细胞可识别多个肿瘤相关靶点以避免肿瘤异质性导致的免疫逃逸,并且通过杀死肿瘤内过表达NKG2DL的新生血管、杀死免疫执行的辅助T细胞、招募髓系细胞和活化巨噬细胞重塑肿瘤免疫微环境等提高免疫效果,以上研究结果为NKG2DLs阳性的肝癌治疗提供了新的思路。该研究得到国家自然科学基金U1702289的资助。
文章链接:https://cancerimmunolres.aacrjournals.org/content/7/11/1813