2020年5月15日,卢铀教授团队在放射肿瘤治疗领域顶级期刊红皮杂志International Journal of Radiation Oncology, Biology, Physics发表题为:Effect of low-dose radiotherapy on abscopal responses to hypofractionated radiotherapy and anti-PD1 in mice and NSCLC patients的研究论文,阐述了LDRT对肿瘤微环境的调控及联合抗PD-1治疗的协同作用机制,在此基础上进一步揭示了LDRT强化HFRT的系统性免疫效应及其与免疫治疗联合的协同增效机制。基于此,卢铀教授团队首创低剂量放疗、大分割放疗联合免疫治疗的三联治疗方案,其疗效在荷瘤小鼠动物模型和回顾性的临床数据中得到初步验证。

在本研究中,卢铀教授团队首次提出了原位肿瘤大分割放疗、远位肿瘤低剂量放疗,联合免疫检查点抑制剂的三联治疗模式,并在小鼠模型中初步证实了该三联治疗模式的抗肿瘤效果:三联治疗组取得了最佳的远位肿瘤生长控制(9只小鼠中共有5只达到完全缓解)(图1)。
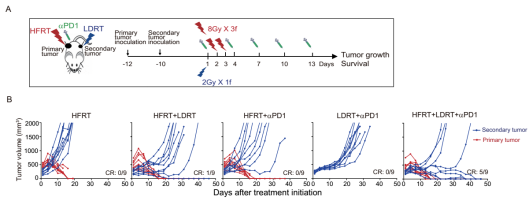
图1
为进一步评估三联治疗方案的临床疗效,卢铀教授团队还回顾性分析了9例接受LDRT+HFRT+免疫治疗的晚期非小细胞肺癌患者(多为2线或以上治疗失败的患者)。结果显示3例患者最佳疗效达到PR,2例患者为SD;中位PFS达到3.7个月,中位OS尚未达到。值得一提的是,9例患者接受LDRT的病灶靶体积均较大(175.7 ± 42.3 cm3),平均放疗剂量仅为4.9Gy(2-8Gy),治疗后6例患者观察到LDRT病灶体积缩小,其平均缩小体积为28%。回顾性数据中未观察到3级及以上治疗相关不良事件,显示这一联合治疗方案安全可耐受。
卢铀教授团队首次揭示了联合不同放疗模式和免疫治疗的三联治疗方案潜在的作用机制(图2):大分割放疗诱导原位肿瘤细胞凋亡,暴露肿瘤特异性抗原,产生“原位疫苗接种”效应,致敏肿瘤特异性T细胞;低剂量放疗促进肿瘤特异性T细胞向远位肿瘤内的迁移,调节远位肿瘤的免疫微环境,两者联合产生CD8+T细胞依赖的免疫效应;PD-1抑制剂通过松开T细胞表面的“抑制性刹车”,恢复T细胞的肿瘤杀伤活性,进一步增强系统性抗肿瘤效应。
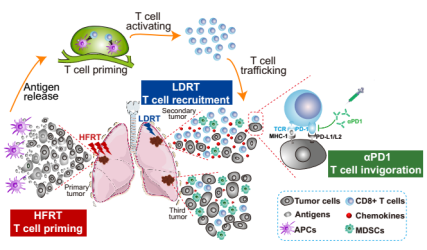
图2
此项研究成果的发表,开拓了放射治疗联合免疫治疗的新策略,提示低剂量放射治疗具有潜在的重要临床应用价值。目前针对这一创新性治疗模式的前瞻性临床研究(NCT 03812549)已在进行中,进一步探索临床疗效和安全性,有望造福更多的晚期肺癌患者。